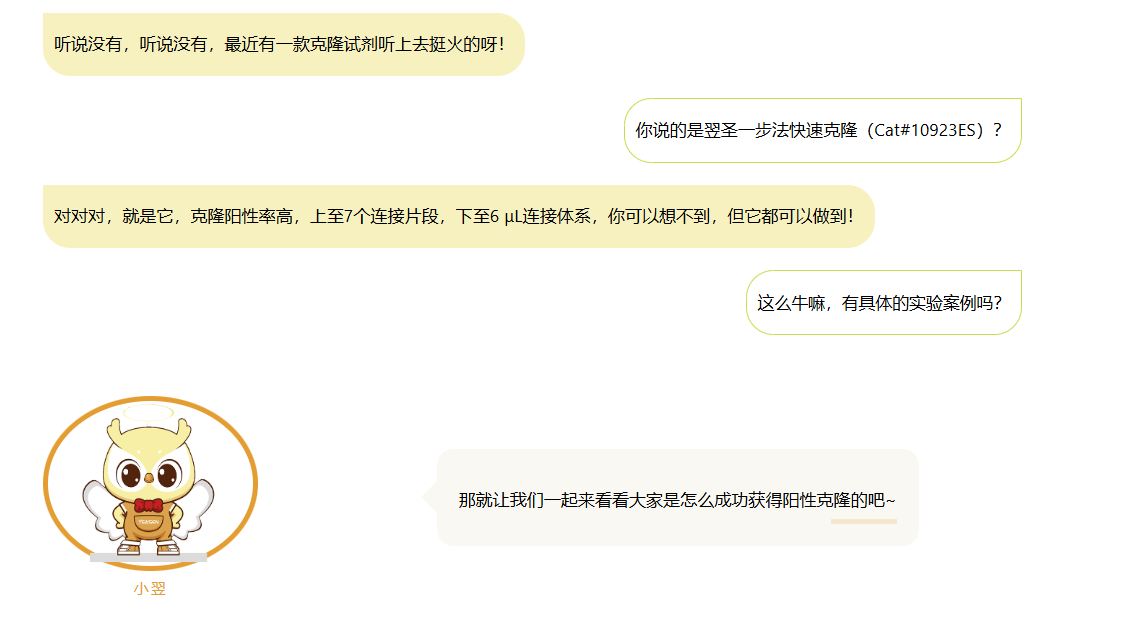
单片段典型实验案例分析
来自同济大学A课题组

//
实验要点
实验思路设计完整。
载体线性化完全,载体、片段均纯化。
载体:片段的摩尔比1:2。
连接反应时间50℃,10 min。(小翌家的10923ES单片段连接也可快至5 min,欢迎尝试~)
实验严谨且验证充分,菌P、测序均验证。
·
//
实验亮点
在10 μL小体系下,通过10923ES克隆试剂盒成功构建了单基因过表达载体,阳性率可达100%。
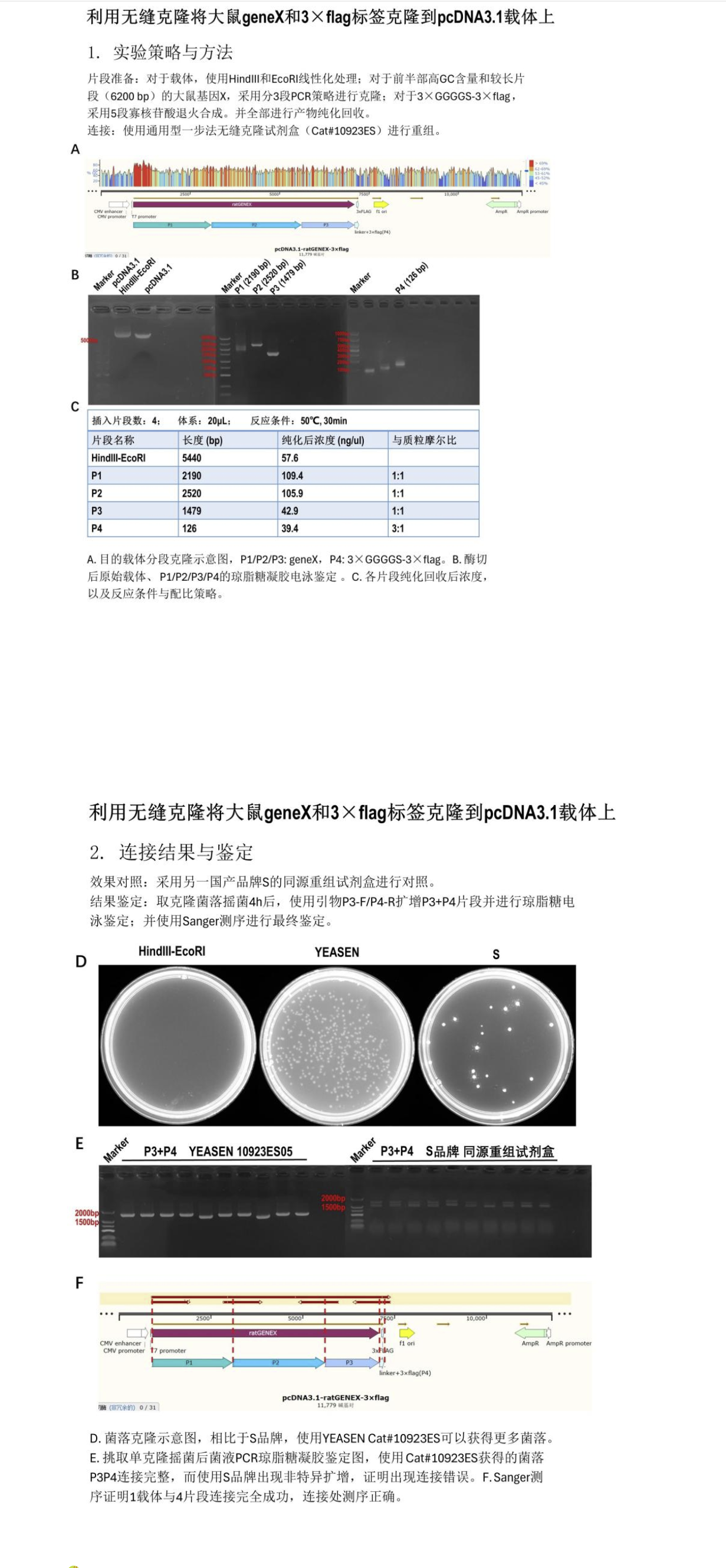
多片段典型实验案例分析
来自同济大学B课题组
//
实验要点
实验思路设计完整。
载体线性化完全,载体、片段均纯化。
载体/片段摩尔比为该实验者经验累计,由1:2调整为1:1和1:3。小翌依旧推荐载体:片段的摩尔比1:2。
连接反应时间50℃,30 min。(此为4片段连接标准时间,小翌严选推荐!)
实验严谨且验证充分,菌P、测序均验证。
//
实验亮点
4片段+载体连接成功,克隆数优于竞品,阳性率100%。片段中包含高GC序列、3×flag标签,片段投入量小于50ng,连接难度较大。
看了以上两位同学的实验结果,你是否也心痒难耐,想要一展身手!
要想获得成功的实验结果,严谨的实验设计思路和适合的实验方法是重中之重。小翌强烈推荐Hieff Clone®系列克隆试剂盒(Cat#10923ES),为您的实验保驾护航!那么实验记录表也是必不可少的,既可以帮助大家记录实验细节,也能通过记录表复盘实验思路,事半功倍!小翌根据自己做实验的经验总结了实验记录本格式,放于文章最后,小伙伴们可自行取用~
|
载体大小 |
bp |
片段大小1、2、3... |
bp |
|
载体酶切位点 |
(如果为反向PCR,可不填) |
片段含同源臂的引物序列 |
|
|
可通过翌圣无缝克隆引物设计软件(https://www.yeasen.com/hieff-clone/)进行引物设计 |
|||
|
线性化载体纯化方式 |
|
片段纯化方式 |
|
|
载体浓度 |
ng/μL |
片段浓度 |
ng/μL |
|
载体投入体积 |
μL |
片段投入体积 |
μL |
|
推荐翌圣官网—支持中心—生物计算器—克隆连接投入量计算板块,输入片段数、浓度、大小,即可获得投入量:https://www.yeasen.com/calculator.html#/cloning-link/ |
|||
|
反应条件 |
温度 ℃、时间 min |
||
|
感受态转化步骤 |
如:小翌的快速感受态细胞 1、提前15 min将LB平板放到37℃培养基中预热。 2、将F-DH5α感受态细胞(DH5α Fast Chemically Competent Cell,Cat#11803ES)从-80℃拿出迅速插入冰上,待菌体融化,加入目的DNA(质粒或连接产物),轻轻弹匀,冰浴静置5 min。 3、用200 μL移液枪将上一步的混合物转移到已经37℃预热的LB培养基上,均匀涂布。 4、将平板置于37℃培养箱倒置过夜培养。若进行蓝白斑筛选操作,平板在37℃至少倒置培养15 h。 |
||
|
挑单菌落 |
用无菌的枪头或牙签将单个菌落挑至新一代快速菌落PCR Mix中混匀(2×Hieff® Ultra-Rapid II HotStart PCR Master Mix,Cat#10167ES),加入引物直接进行PCR反应。共计挑 个单菌落,阳性率 (阳性条带数/单菌落个数)。 |
||
|
测序 |
(推荐使用一条载体通用测序引物+目的片段另一端引物送去测序验证) |
||
明星产品推荐
|
克隆实验流程 |
产品定位 |
名称 |
货号 |
规格 |
|
载体、片段制备 |
高保真PCR |
2× Hieff Canace® AdvanceFast PCR Master Mix (With Dye) |
1 mL/5×1 mL |
|
|
同源重组 |
1-7片段一步法定向连接,最快5分钟完成重组反应 |
Hieff Clone® Universal II One Step Cloning Kit |
20 T/50 T |
|
|
转化 |
5 min快速完成感受态转化 |
F DH5α化学感受态 |
10×100 μL |
|
|
菌落PCR |
快速PCR升级,可菌P且适用复杂模板扩增 |
2×Hieff® Ultra-Rapid II HotStart PCR Master Mix |
1 mL/5×1 mL |
|
|
目的片段保存、测序 |
TOPO克隆-兼容TA/平末端 |
Hieff Clone® Universal Zero TOPO TA/Blunt Cloning Kit |
20 T |
