肿瘤分子分型:通过NGS、蛋白质组等组学技术,对肿瘤进行分子谱的系统描绘,并根据分子特征谱,进行肿瘤的精准分类及精准诊疗研究。分子分型已成为国家精准医疗战略的重点研究投入方向;也备受CNS顶刊杂志青睐。为了帮助广大临床研究者了解肿瘤分子分型及诊疗研究的重大前沿进展,我们收集整理了近几年来发表于Cell、Nature、Cancer Cell等顶刊上的,基于蛋白质组及蛋白基因组的肿瘤分子分型相关研究论文。【肿瘤分子分型专辑】每周1篇,为大家精细解读重磅研究与进展。
【文章题目】:Integrated Omics of Metastatic Colorectal Cancer
【癌种】:肠癌
【细分癌种】:早期非转移性&转移性结直肠癌(CRC)
【地域】:中国大陆
【通讯单位】:中科院上海生化细胞所
【发表时间】:2020年
【涉及组学】:全外显子测序、DNA甲基化芯片、DIA蛋白组学、DIA磷酸化蛋白组学
【文献出处】:
DOI: https://doi.org/10.1016/j.ccell.2020.08.002
1.针对中国患者转移性结直肠癌的大规模蛋白基因组学研究,绘制首个中国人结直肠癌多组学整合分子特征谱
2.蛋白质组学与磷酸化蛋白组学图谱可成功识别肿瘤转移并预测药物反应
3.建立了完整的从多组学数据集生成到in vivo药物敏感测试模型的分析流程
4.改进对无可用药物突变型患者的治疗策略的选择
【流行病学】:
结直肠癌(CRC)是全球第四大致命性癌症,每年有近90万人死亡。年龄、不良的饮食和生活方式都会增加结直肠癌的风险。尽管治疗手段不断进步,但CRC,特别是转移性CRC的死亡率在癌症相关死亡中仍然很高。CRC表现出高度的异质性。
多组学特征预期有助于改善治疗,从而导致精确和个性化的护理。已有的多组学研究更多地关注非亚洲人口中的非转移性CRC,对于中国的患者的治疗并不完全适用。
【主要驱动基因】:APC, TP53,KRAS
【主要样本】:早期-非转移性CCRC、转移性CCRC患者,经手术切除的组织(原发癌组织(T),近端癌旁组织(P),远端正常组织(N));及转移性CCRC的远端肝转移肿瘤组织(LM)
【样本状态】:新鲜冰冻
【样本数量】:76对早期-非转移CCRC、70对转移性CCRC、43例远端肝转移灶
【主要研究路线与内容】:
1. 单组学分析:组别:原发灶癌组织(T) VS 远端正常组织(N);
转移灶癌组织(LM) VS 远端正常组织(N)等WES:基因拷贝数、基因突变;与TCGA队列比较
DIA蛋白组 & MRM靶向蛋白组:蛋白鉴定与定量数量
DIA磷酸化蛋白组:修饰蛋白、修饰肽段鉴定与定量数量
二、原发灶-中国人群结直肠癌(CCRC)基因组情况
1. 对146例患者组织样本进行基因组学检测,最常见的突变基因为APC(65%),TP53(64%)以及KRAS(32%)。
2. 中国人群特征:我国队列CCRC数据,与TCGA以及MSK数据比较
(1)病理差异:三个队列临床病理特征存在明显差异,且CCRC中直肠癌发病率更高,转移性CRC(mCRC)的比例更高。
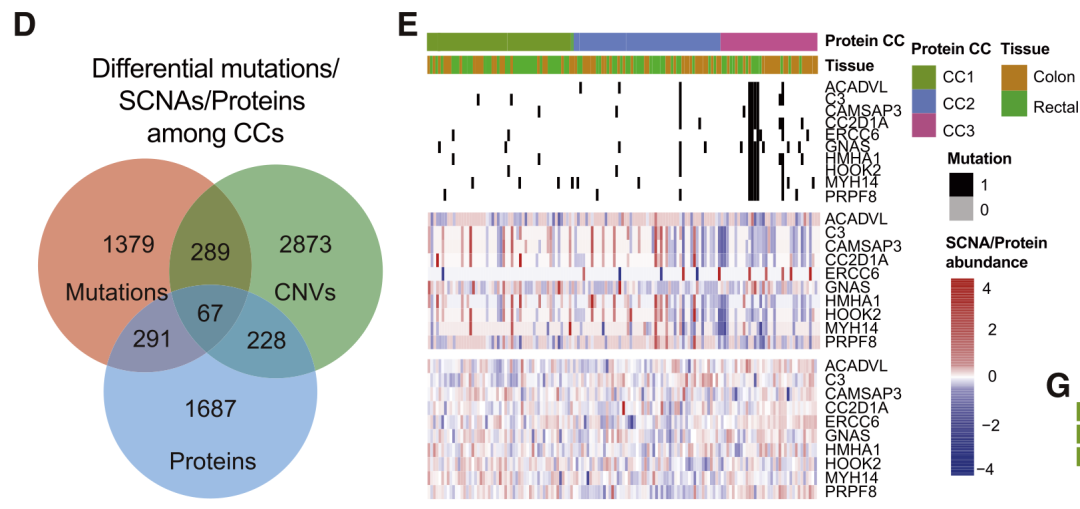
(2)基因突变差异:中国人群的CCRC特有突变特征,包括APC和TP53突变频率略低,而PRRC2A、PPFIA4、CPD和NURP1L等突变频率更高。3.转移性CRC特征:对中国人群中转移性与非转移性人群(mCCRC与non-mCCRC)进行了基因突变特征的对比:①mCCRC整体突变负担更低;②SMAD4和XIRP2基因突变频率升高;③多克隆结构增多。鉴定了中国人群CCRC的主要基因突变;同时对比了mCCRC与non-mCCRC的基因突变特征,建立了完整的中国人群CCRC基因变异景观。1.蛋白质组分型:作者对146名CCRC患者原发肿瘤和远端正常组织进行DIA蛋白组学分析,通过共识聚类将其分成三个亚型(CC):CCI型集中在RNA加工和DNA错配修复(MMR);CC2型集中在细胞外基质-受体整合、粘着斑和免疫相关途径;CC3型集中在DNA复制和代谢途径激活。2.亚型的临床预后特征:三种亚型具有不同的无复发生存率,亚型是独立预后因素。此外,对于转移性患者,CC3型也较CC1/2型预后差。3.亚型的分子表达特征:(1)CC3型:三个亚型之间的差异突变基因、SCNA以及差异蛋白有一定重叠,更多的突变显著富集于CC3型;其中大多数SCNA在CC3亚型中出现更多的拷贝数删除,并在蛋白水平上出现更高的表达。(2)CC2型:DNA错配修复(MMR)通路相关蛋白在CC2型中显著下调。DNA甲基化分析发现其基因甲基化水平明显与蛋白表达水平负相关。说明CC2型具有独特的表观遗传特征。
4.与其他已报道分型的比较:将该蛋白质组分型与CPTAC蛋白质组数据集以及CMS分类进行比对,发现分型结果总体上保持一致:CC1型与CPTAC亚型A和E相匹配,分别包含CMS1和CMS3,并且预后相对较好;CC2型,与C和CMS4亚型相似,预后比CC1型差;CC3型蛋白质组对应于CPTAC B型,以及多种类型的CMSs,体现了该亚型的复杂性。
利用蛋白质组学数据建立了CRCC三种分型,三种亚型具有不同的分子和预后特征,且与已有数据集的分型具有一致性。
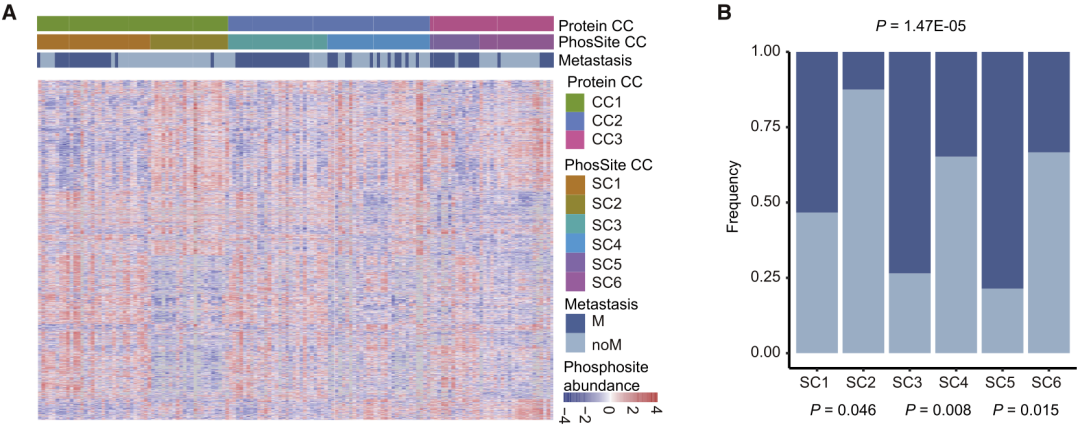
四、原发灶—磷酸化蛋白质组的CCRC分子分型:磷酸化蛋白组学可以区分mCCRC与non-mCCRC
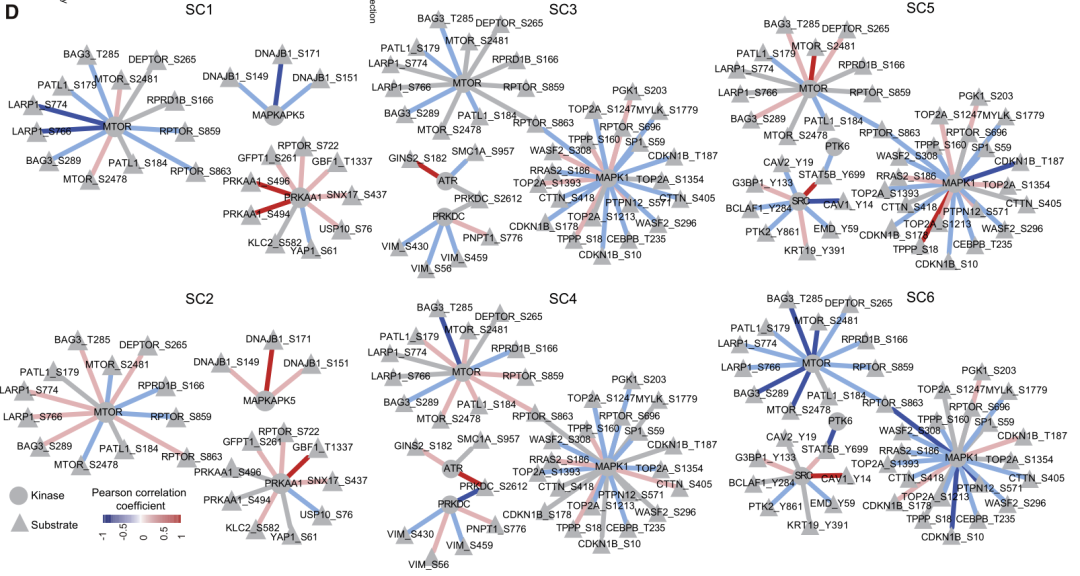
1. 磷酸化蛋白组的分型:研究者对CCRC患者的原发肿瘤和远端正常组织进行DIA磷酸化蛋白质组学分析,从中发现了1487个差异磷酸化位点。进一步通过共识聚类,将其分为六个亚型。有趣的是,磷酸化蛋白组学数据可将non-mCCRC与mCCRC进行分离(SC1、3、5型富含mCCRC患者;而SC2、4、6型富含non-mCRC患者),但基于蛋白组学的三种亚型中mCRC与non-mCRC没有显示出明显的区分。2.磷酸化蛋白亚型的分子功能特征:对差异磷酸化的蛋白质进行了功能富集分析,发现在SC1,SC3和SC5中高表达的磷酸化蛋白在粘着斑和粘附连接途径中富集;在SC2,SC4和SC6中上调的磷酸位点则在ERBB2信号转导、子宫内膜癌、抗原加工和呈递及FcγR介导的吞噬途径中富集,这些上调的磷酸化蛋白在亚型间的特性不强。3.磷酸化蛋白亚型的激酶-底物关联特征:激酶底物关联分析发现,SC1,SC3和SC5中的激酶与磷酸酶之间大多呈负相关,而SC2和SC4中的正相关则呈正相关。比较特殊的是SC6,其特征为激酶与底物之间呈负调控,这表明CC3中的non-mCRC更像是mCRC,且具有较差的预后。磷酸化蛋白组学可以更细分mCRC与non-mCRC,对蛋白质组学分析做有效补充。此外,不同的亚型具有不同的磷酸化-底物关联特征,并且可能与预后有关。
基因组水平:原发灶和转移灶在基因水平上整体具有高度一致性,包括驱动基因突变及SCNA。与原发灶相比,转移灶的单克隆比例更高。这些结果表明转移灶源自原发灶或相同的祖先克隆。
2.蛋白组水平:转移灶的蛋白质组学分析显示与原发灶明显不同。与原发灶相比,转移灶比正常组织表现出更多的蛋白表达上调,这些差异表达的蛋白质清楚地将转移组织与原发组织区分开:1)转移灶中上调蛋白主要集中在ECM-受体互作、药物代谢、细胞粘附和紧密连接相关;2)转移灶中下调蛋白集中在代谢途径、脂肪酸降解、TCA循环和氧化磷酸化中。转移灶与原发灶的蛋白基因组学对比,显示二者基因组学上的同源性与蛋白组水平上的异质性;相比于基因足,蛋白质表达差异可以有效地对转移灶与原发灶进行区分。六、转移性CCRC的磷酸修饰位点与蛋白的表达协变特征1. 磷酸化位点与蛋白的表达相关性:研究者分析了42例mCRC患者(10例CC1型,21例CC2型,11例CC3型)的所有四种组织类型(N,P,T和LM)。研究者针对每一例mCRC,计算了所有4个组织中每两个匹配的磷酸化位点丰度和蛋白质丰度之间的相关系数。为进一步寻找三种CC亚型的磷酸化位点-蛋白共调控关系,研究者利用ANOVA鉴定出了在三种亚型中存在显著差异的954种磷酸化-蛋白关系对(CC2表现出明显的负向调控、CC1和3表现出更多的正相关)。
2.磷酸化位点-蛋白对的分类及特征:(1)这954个磷酸化-蛋白关系对可将三个亚型进行有效区分,并且可被分为三个cluster:CC1neg、CC2neg和CC3neg。CC3neg富集于平滑肌收缩、伤口响应等功能;CC1neg于LIS1途径、内吞作用、P75 NTR受体信号等;CC1neg显着参与mRNA代谢过程、核糖核蛋白复合生物发生等。(2)利用激酶底物注释,进一步发现CC3neg具有最多的激酶富集,且3种cluster无共有上游激酶。对应于10激酶的14个磷酸化位点存在显着的共同调节。
(3)研究者利用MCODE复合/子网络分析方法,发现了五个核心网络,包含了112个节点和355个连接,并对CC1neg、CC2neg和CC3neg中的特异的核心网络进行了展示。其中TP53和LKB1通路是CC1neg和CC3neg的top MCODE;而mRNA 剪切体复合物是CC2neg的top。磷酸化位点-蛋白的相关性分析显示,即使是同一个病人,其不同的组织(N,P,T和LM)中存在的磷酸化-蛋白的关联具有不同的特征,且与亚型相关。1. 亚型的激酶活性特征:作者对每种CC亚型的mCRC原发和转移组织中差异丰富的磷酸化位点进行分析,并推断出相应激酶的活性。作者发现不同的CC亚型富含不同激酶。且同一亚型的原发灶与转移灶中,同一激酶也会表现出不同活性。例如CDK5仅在CC1型的原发灶表现出高活性;MAPK1在CC3型的原发灶和转移灶均具有高活性,但在其他亚型中无此活性。
2.亚型的激酶-磷酸化底物表达与网络特征:进一步同时考虑蛋白表达水平的变化。作者发现激酶及底物的表达在不同亚型中也同样具有高度异质性。进一步基于蛋白-底物相关系数,构建不同亚型原发灶及转移灶的共表达网络。同样的,蛋白-底物网络也呈现出不同亚型及不同组织间的特异性差异;并且同一亚型的原发灶与转移灶之间的差异,大于各亚型的原发灶之间的差异。
通过分析不同亚型中的激酶表达与活性,揭示了潜在的药物治疗靶点。但无论是激酶活性,还是激酶-底物表达网络,均呈现出原发与转移灶间的高度异质性,提示即使是同一病人,其不同组织对药物的敏感性也可能会不同。1.三种激酶抑制剂的PDX模型治疗响应测试:为进一步探索mCCRC患者药物反应潜力,研究者对31种miniPDX模型中的三种激酶抑制剂(阿法替尼、吉非替尼和雷戈非尼)进行药理测试,其中包括9对原发性转移肿瘤和13种原发肿瘤。研究者通过肿瘤生长抑制来评估不同药物效果,并进一步确定同一人的原发灶和转移灶对同一药物表现出不同的反应。此外,值得注意的是,CCRC-0323 组织具有regorafenib的高响应,与其具有RAF1基因突变一致;但虽然其同样存在ERBB2基因突变,但却对ERBB2抑制剂afatinib无响应。而CCRC-0397组织,没有RAF1突变,却对上述两种抑制剂均有良好的响应。此结果表明,磷酸化蛋白组对药物选择的指示比基因突变信息更敏感。2.药物治疗响应预测模型:研究者建立了基于1696个边缘强度特征的弹性回归模型,用于预测药物反应。该模型对上述抑制剂响应的预测结果,与实际结果具有高度一致性,证实激酶-磷酸底物网络在预测mCCRC患者药物敏感性方面具有强大潜力。此外,作者发现EFGR与PTPN1-Y8的正相关性,以及EFGR与IRS1-S3的负相关性,均对afatinib的响应有贡献,说明药物响应并不是单因素决定的,而需要多个分子信息协同指征。进一步证实了同一病人的不同组织对药物的敏感性会有所不同。基于激酶-底物表达网络,构建了能够有效预测药物治疗响应的模型。同时,进一步强调了蛋白水平、磷酸化水平,以及多分子水平对药物选择的必要意义。
该研究系统性分析了146例中国人群队列的结直肠癌患者组织的基因组学、蛋白质组学和磷酸化蛋白质组学数据,包括其中的70例转移性患者。蛋白质组学区分了三种CCRC亚型,各亚型具有不同的临床预后和分子特征;磷酸化蛋白组学数据有助于进一步区分转移和非转移患者。原发灶与转移灶表现出基因水平的高度相似性,但在蛋白组水平上存在显著差异。该研究进一步构建了激酶-底物网络模型进行药物响应的预测,并进行了PDX模型的药效学测试验证。药效测试结果进一步发现:即使同一患者,原发灶和转移灶对同一药物也表现在不同的药物敏感性;激酶-底物对药物敏感性的预测,比药靶基因信息更加敏感和有效。综上所述,该研究为中国人CRC研究提供了有价值的数据资源,有利于更好地理解转移性CRC,并提供了临床应用的潜力。