FITC-xtra 异硫氰酸荧光素具有与FITC几乎相同光谱特性,温和缀合条件下比FITC的缀合产率高。在相同条件下,FITC-xtra抗体缀合物提供比FITC标记的缀合物的信号/背景比高得多。
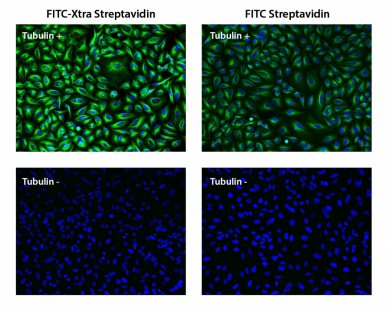
图1.将HeLa细胞与带有(Tubulin+)或不带有(Tubulin-)的小鼠抗微管蛋白抗体以及生物素化的山羊抗小鼠IgG孵育,然后分别用FITC-Xtra链霉亲和素偶联物(绿色,左)或FITC-链霉亲和素偶联物(绿色,右)染色。细胞核用Hoechst 33342(蓝色,Cat#17530)染色。
FITC-xtra 异硫氰酸荧光素适用范围
用于标记蛋白质
FITC-xtra 异硫氰酸荧光素优势
1.光稳定性好
2.荧光不受pH(4-10)影响
FITC-xtra 异硫氰酸荧光素实验方案
(该标记方案适用山羊抗小鼠IgG与FITC-xtra的偶联物)
准备蛋白质储备溶液(溶液A)
将100μL反应缓冲液(例如,1M碳酸钠溶液或pH~9.0的1M磷酸盐缓冲液,)与900μL目标蛋白溶液(例如抗体,蛋白质浓度> 2 mg / ml)混合,得到1 mL蛋白标记储备液。
注:1.蛋白质溶液(溶液A)的pH值应为8.5±0.5。如果蛋白质溶液的pH低于8.0,则使用1M碳酸氢钠溶液或1M pH 9.0磷酸盐缓冲液,将pH调节至8.0-9.0的范围。
2.应将蛋白质溶于pH7.2-7.4的1X磷酸盐缓冲盐水(PBS)中。如果蛋白质溶解在Tris或甘氨酸缓冲液中,则必须用pH7.2-7.4的1X PBS透析,以除去用于蛋白质沉淀的游离胺或铵盐(例如硫酸铵和乙酸铵)。
3.不纯的抗体、牛血清蛋白(BSA)和明胶稳定的抗体不能很好的被标记。叠氮化钠或硫柳汞的存在也可能干扰缀合反应。通过透析或旋转柱除去叠氮化钠或硫柳汞,以获得标记结果。
4.如果蛋白质浓度小于2mg / mL,偶联效率明显降低。为获得好的标记效率,建议蛋白质浓度范围为2-10 mg / mL。
准备染料储备溶液(溶液B)
将无水DMSO加入到FITC-xtra小瓶中以制备10-20mM储备溶液,通过移液或涡旋混合均匀。
注:在开始缀合之前准备染料储备溶液(溶液B)随配随用,保证使用的溶液的新鲜。染料储备溶液的长期储存可降低染料活性。溶液B可以在不受光照和潮湿的情况下储存在冰箱中两周。
准备所需的蛋白质缀合物
注:每种蛋白质都需要不同的染料/蛋白质比例,这也取决于染料的性质。蛋白质的过度标记可能对其结合亲和力产生不利影响,而低染料/蛋白质比率的蛋白质缀合物会降低灵敏度。我们建议您通过使用连续不同量的标记染料溶液重复步骤4和5来实验确定染料/蛋白质比率。通常,对于大多数染料 - 蛋白质缀合物,推荐使用4-6种染料/蛋白质。
1.使用10:1摩尔比的溶液B(染料)/溶液A(蛋白质)作为起始点:将5μl染料储备溶液(溶液B,假设染料储备溶液为10 mM)加入到蛋白质的小瓶中溶液(95μl溶液A),有效摇动。假设蛋白质浓度为10mg / mL并且蛋白质的分子量为~200KD,蛋白质的浓度为~0.05mM。
注意:蛋白质溶液中DMSO的浓度应<10%。
2.进行缀合反应。在有效摇动下将适量的染料储备溶液(溶液B)加入到蛋白质溶液(溶液A)的小瓶中。继续在室温下旋转或摇动反应混合物30-60分钟。
3.重复#3.2,溶液B /溶液A的摩尔比为5:1; 如果需要,分别为15:1和20:1。
4.使用预制的旋转柱或其他技术纯化所需的缀合物。
5.计算上述4种缀合物的染料/蛋白质比(DOS)。
