
败血症是指机体对病原体感染的先天免疫反应失调,可导致组织损伤,甚至危及生命。巨噬细胞的持续激活可能是加速脓毒症反应的机制。而巨噬细胞中的代谢级联反应被认为是其激活的特征。EGFR(表皮生长因子受体)是一种跨膜受体酪氨酸激酶,可与TLR4(Toll 样受体 4)共同调节内毒素血症中巨噬细胞的激活,EGFR的磷酸化增加了TLR4细胞表面表达和信号转导。然而,巨噬细胞中EGFR在LPS(脂多糖)作用下的胞内转运过程及其生理意义尚不清楚。
2022年11月,广东医科大学附属医院麻醉科唐靖课题组与解放军南部战区总医院刘志峰课题组合作在Cell Death & Disease(IF9.685 )期刊上发表了题为“EGFR tyrosine kinase activity and Rab GTPases coordinate EGFR trafficking to regulate macrophage activation in sepsis”的文章,该研究利用磷酸化修饰组和代谢组学等方法发现LPS可增加巨噬细胞表面EGFR的表达,Rab10有助于EGFR的质膜运输。Rab5a介导早期EGFR内吞,而EGFR/MAPK14/Rab7a调节晚期EGFR内吞。此外,抑制细胞表面EGFR表达降低M1极化,并通过激活ppar γ介导的谷氨酰胺代谢促进M2极化。 最后,抑制EGFR磷酸化使巨噬细胞的平衡从M1向M2倾斜,并减弱了LPS诱导的炎症和组织损伤。中科新生命提供了磷酸化修饰组和非靶向代谢组技术服务支持。
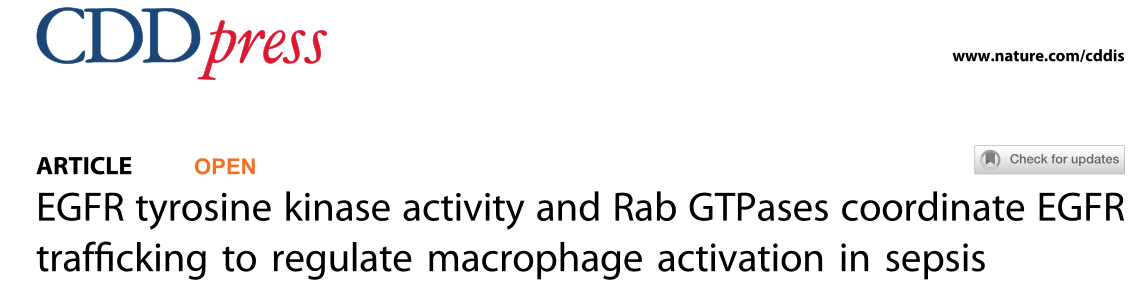
研究材料
CLP诱导的脓毒症小鼠模型、BMDM和RAW264.7巨噬细胞、临床急性脓毒症患者中的巨噬细胞
技术路线
步骤1:LPS促进巨噬细胞表面EGFR的激活和表达;
步骤2:EGFR/MAPK14/Rab7a(S72)调节晚期EGFR内吞;
步骤3:Rab5a介导EGFR在巨噬细胞中的早期内化;
步骤4:Rab10促进EGFR从高尔基体运输到细胞表面;
步骤5:抑制EGFR磷酸化可抑制巨噬细胞中M1极化、通过激活PPARγ调节谷氨酰胺代谢促进M2极化;
步骤6:抑制EGFR磷酸化可使M1表型转变为M2表型,减轻脓毒症引起的急性肺损伤。
研究结果
本研究发现在BMDM和RAW264.7两种巨噬细胞中证实LPS均可激活EGFR的细胞表面的表达(图1A-1F)。在CLP(盲肠结扎穿刺)诱导的脓毒症小鼠模型和临床急性脓毒症患者中,巨噬细胞表面的EGFR的表达量均较正常组明显升高(图1G-1K)。综上所述,LPS诱导脓毒症巨噬细胞表面EGFR的激活,并促进EGFR的表达。
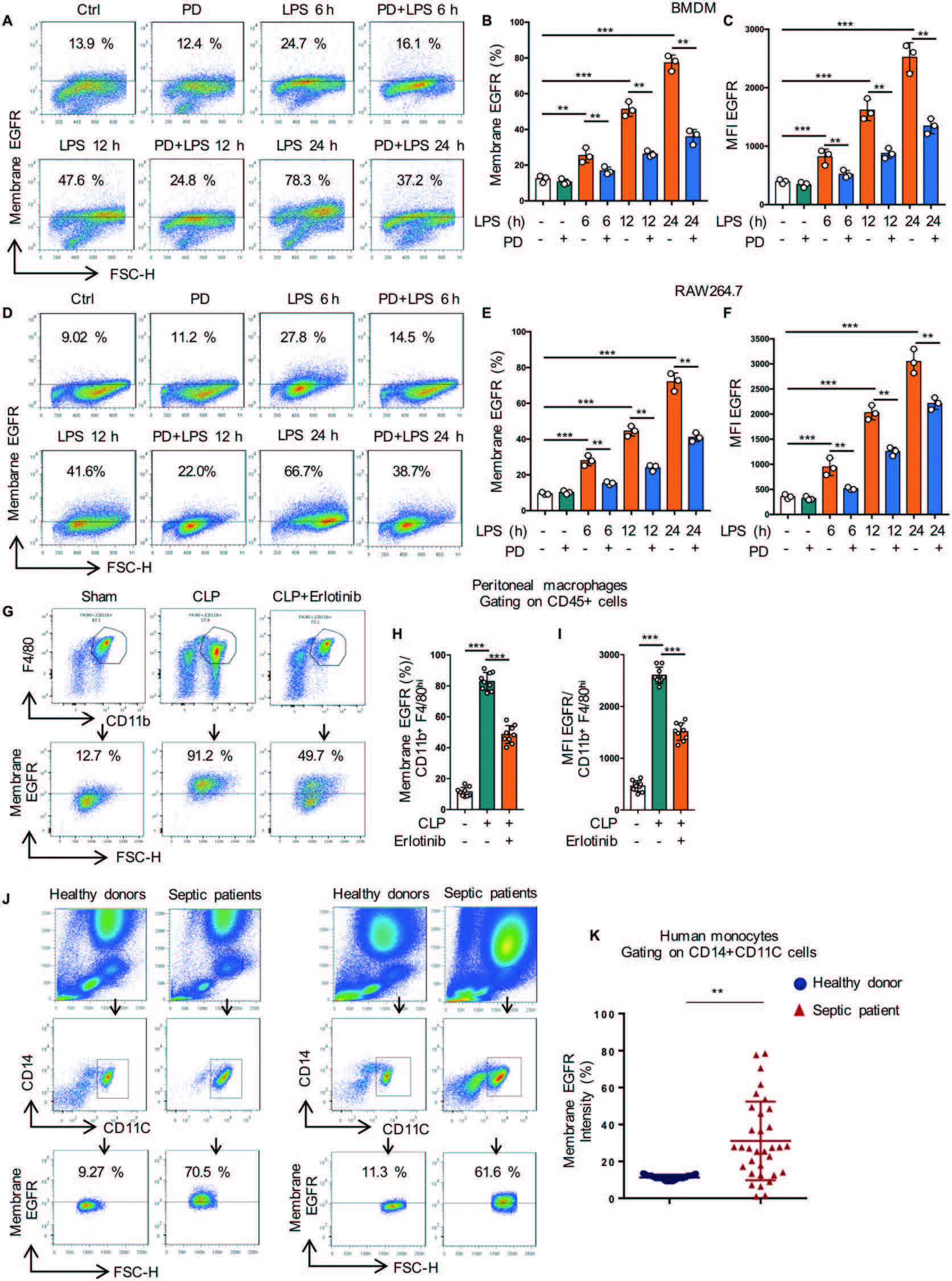
图1 LPS促进巨噬细胞表面EGFR的表达LPS促进巨噬细胞表面EGFR的表达
2. Rab7a的S72磷酸化促进晚期EGFR内吞
抑制EGFR磷酸化显著降低了巨噬细胞膜中EGFR的表达,提示EGFR激酶活性在受体运输中起重要作用。为了发现EGFR激酶新的下游靶点,作者采用定量磷酸化修饰蛋白组学的方法对RAW264.7细胞进行分析(对照组、LPS处理组、EGFR抑制剂(PD168393)+LPS共同处理组)。总共分析了11772个独特的磷酸位点,对应了8151个肽片段、3041个独特的蛋白质。磷酸化修饰组学中的KEGG通路分析发现磷酸化肽主要富集于MAPK信号通路、内吞和糖酵解通路(图2B)。在差异的磷酸化肽段中,只有Rab7a被报道参与了细胞内吞通路,Rab7a GTPase参与调节胞吞介导的蛋白转运,特别是Rab7A促进了生长因子受体等膜受体从早期核内体到晚期核内体和溶酶体的运输,因此作者重点研究了RAB7a磷酸化与EGFR转运之间的关系。修饰组学发现Rab7a在S72位发生磷酸化修饰(图2C-2D)(经WB和点突变、模拟突变方式证实RAB7a在S72发生了磷酸化修饰(图3A-3D))。为研究S72磷酸化对Rab7a的GTPase活性的影响,作者分析了LPS处理的巨噬细胞中, Rab7a与CD63(晚期核内体)、LAMP1(自噬体成熟阶段相关蛋白)的共定位(图3E-3J),结果表明Rab7a磷酸化调节了EGFR的后期内吞降解,从而影响了EGFR的膜表达。
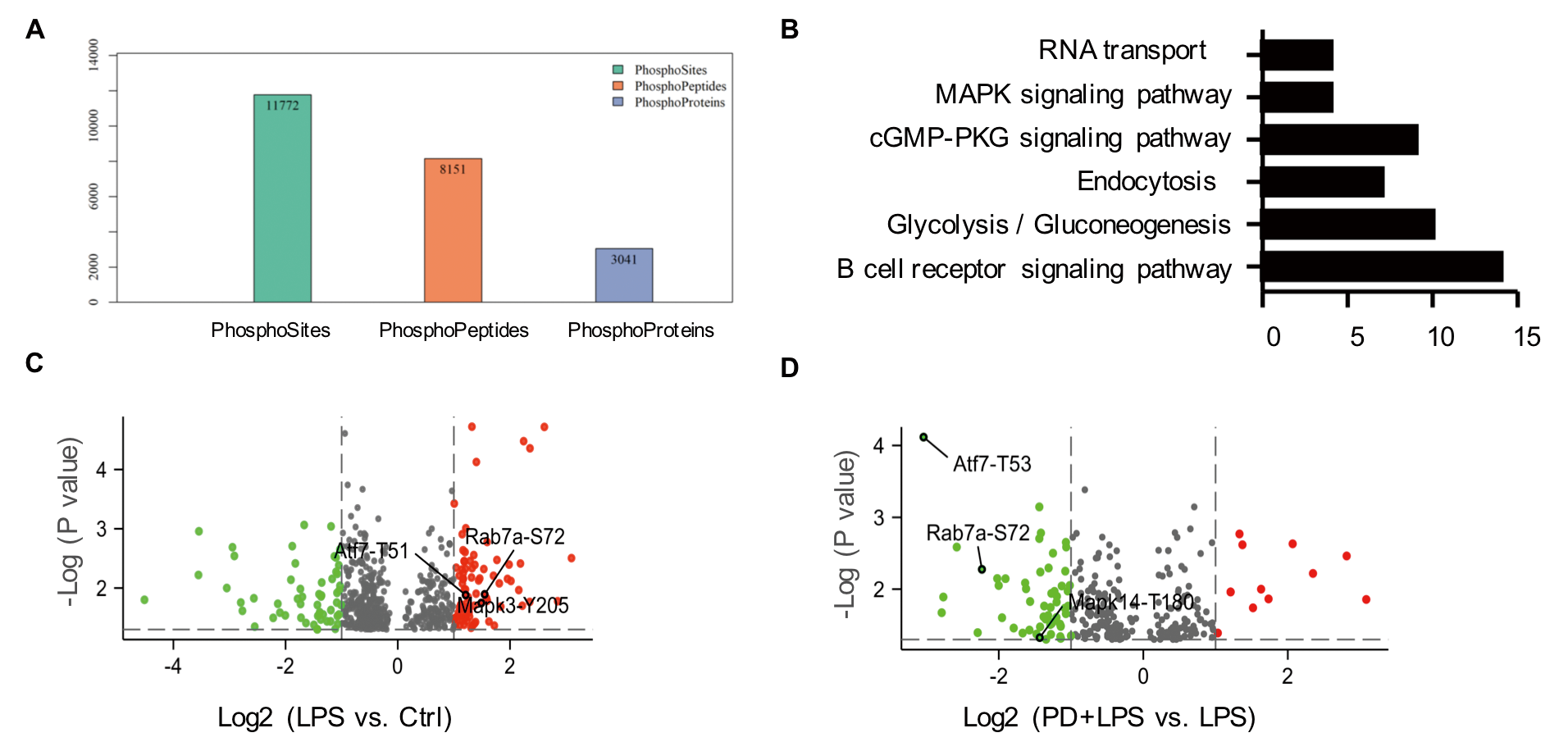
图2 磷酸化修饰组学KEGG通路和差异表达肽段分析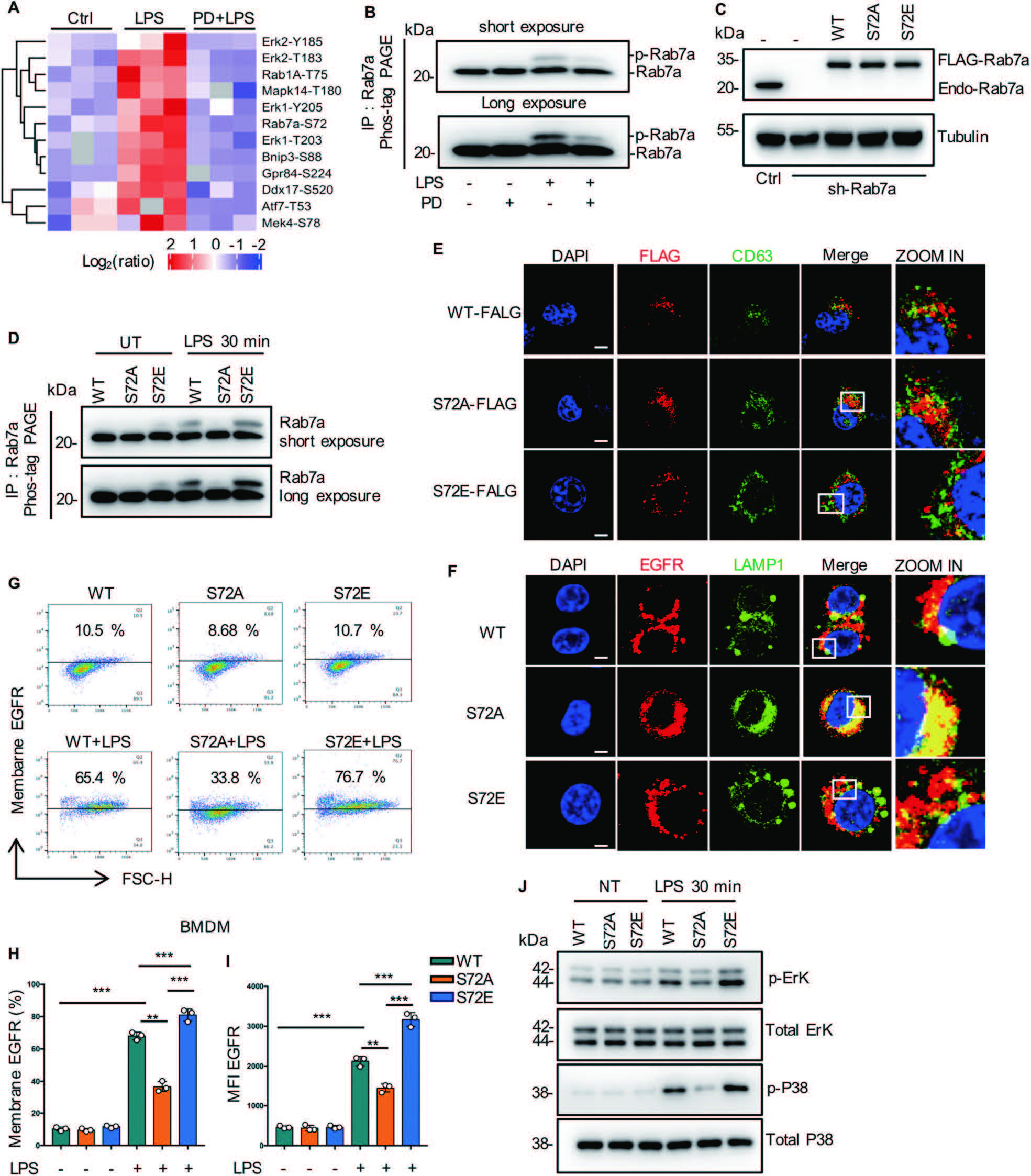
图3 Rab7a的S72磷酸化促进晚期EGFR内吞
3. MAPK14磷酸化Rab7a的S72位点
根据磷酸化修饰组学的结果,作者推测Rab7a的S72磷酸化是受EGFR/MAPK14通路影响的。作者通过共定位(图4A)以及体外、体内(加入MAPK14抑制剂)共沉淀(图4B-4E)和MAPK14/ Rab7a-S72点突变(图4G)的方式证实了MAPK14可以直接结合并磷酸化Rab7a,Rab7a S72是MAPK14磷酸化的主要位点。为了了解MAPK14介导的Rab7a磷酸化在EGFR细胞内转运调控中的作用,作者分析了MAPK14敲除和CD63、LAMP1的共定位(图4D-4O),结果表明MAPK14介导的Rab7a磷酸化调控了LPS激活的巨噬细胞的晚期内吞和EGFR降解。
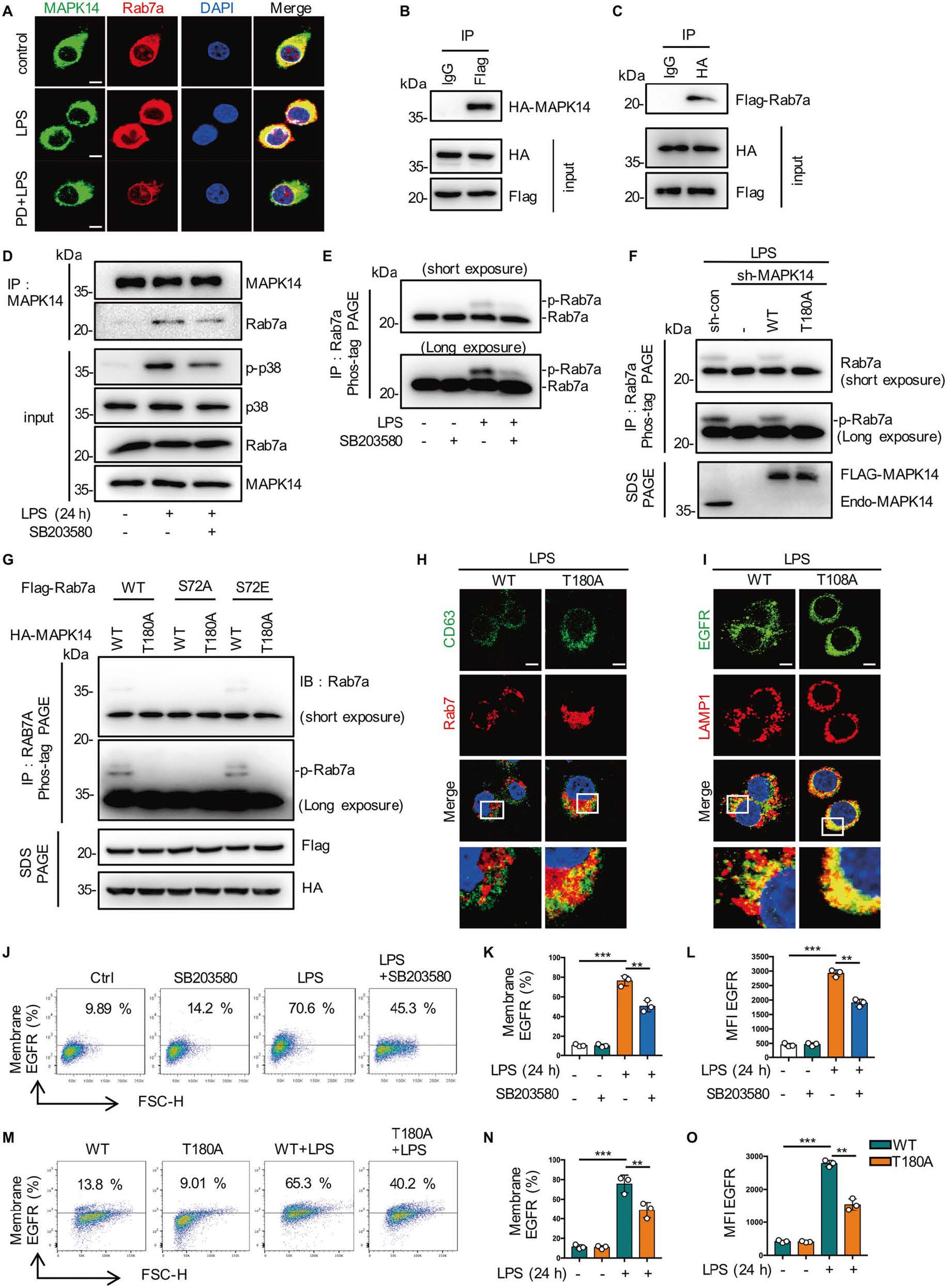
图4 MAPK14磷酸化Rab7a的S72位点
4. Rab5a介导EGFR在巨噬细胞中的早期内化
生长因子受体的内吞转运是EGFR信号通路时空调控的重要细胞机制之一。研究发现LPS处理巨噬细胞1小时后,PD168393预处理组中早期核内体(EEA1)和EGFR之间的共定位减弱。由于Rab5a是细胞内吞作用的关键调节因子,作者将Rab5a与EGFR进行了免疫共沉淀和免疫荧光染色发现了两者的共定位。随后通过Rab5a的敲除以及其效应蛋白抑制剂的添加、Rab5a敲除小鼠的验证,证实LPS诱导的EGFR早期内化是由Rab5a介导的(图5)。
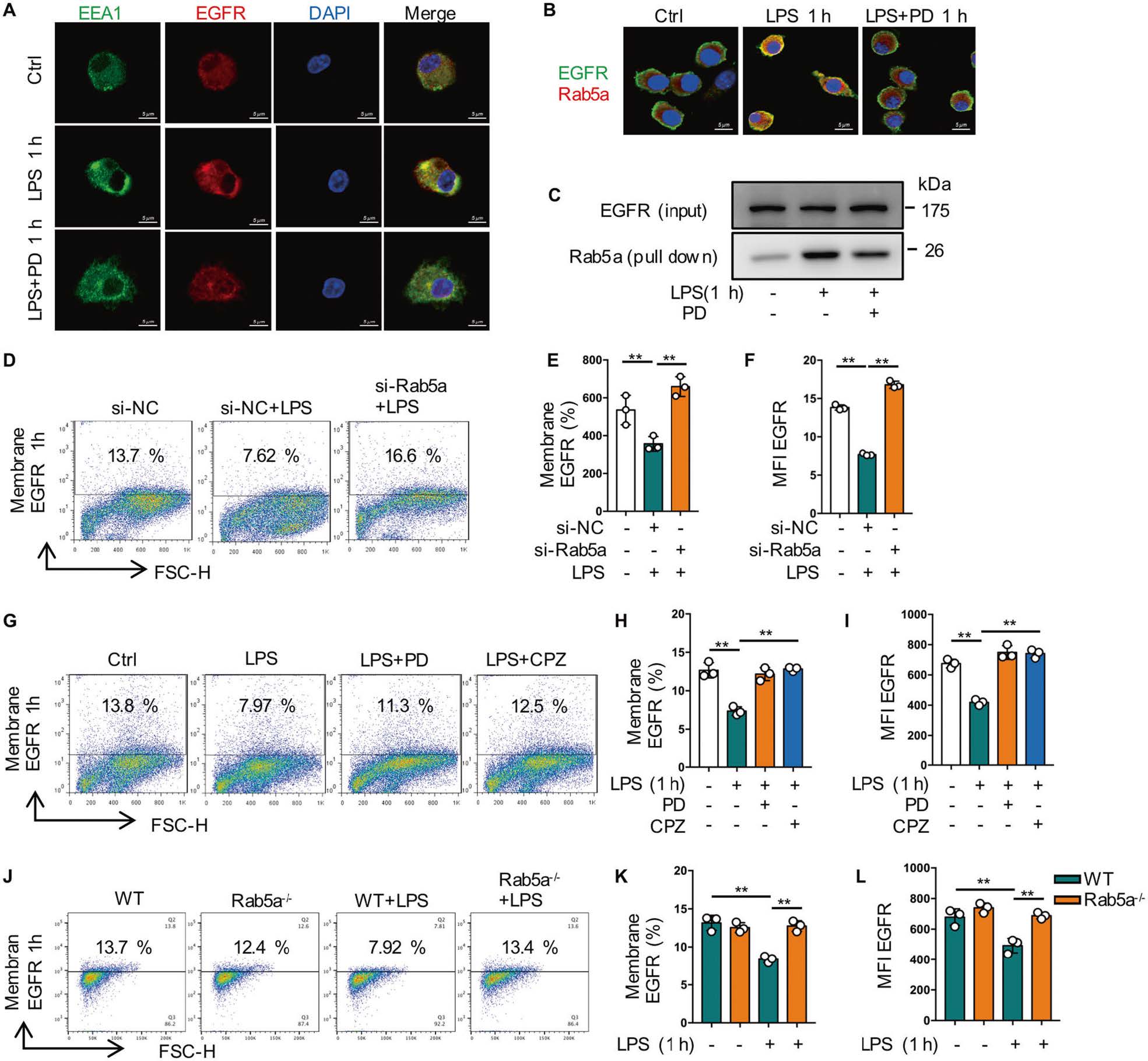
图5 Rab5a介导EGFR在巨噬细胞中的早期内化
5. Rab10促进EGFR从高尔基体运输到细胞表面
为了寻找EGFR细胞表面表达的细胞调控机制,作者将重点放在Ras家族的小g蛋白上。Rab10主要参与蛋白质从高尔基体到质膜的运输。作者发现Rab10定位于高尔基体和EEA1,但不定位于晚期核内体。同时,Rab10和EGFR共定位。此外,Rab10沉默的巨噬细胞表面EGFR表达明显降低(图6A-6G)。随后通过构建Rab10的突变细胞系及EGFR的表面表达,证实Rab10促进EGFR从高尔基体运输到细胞表面(图6H-6M)。
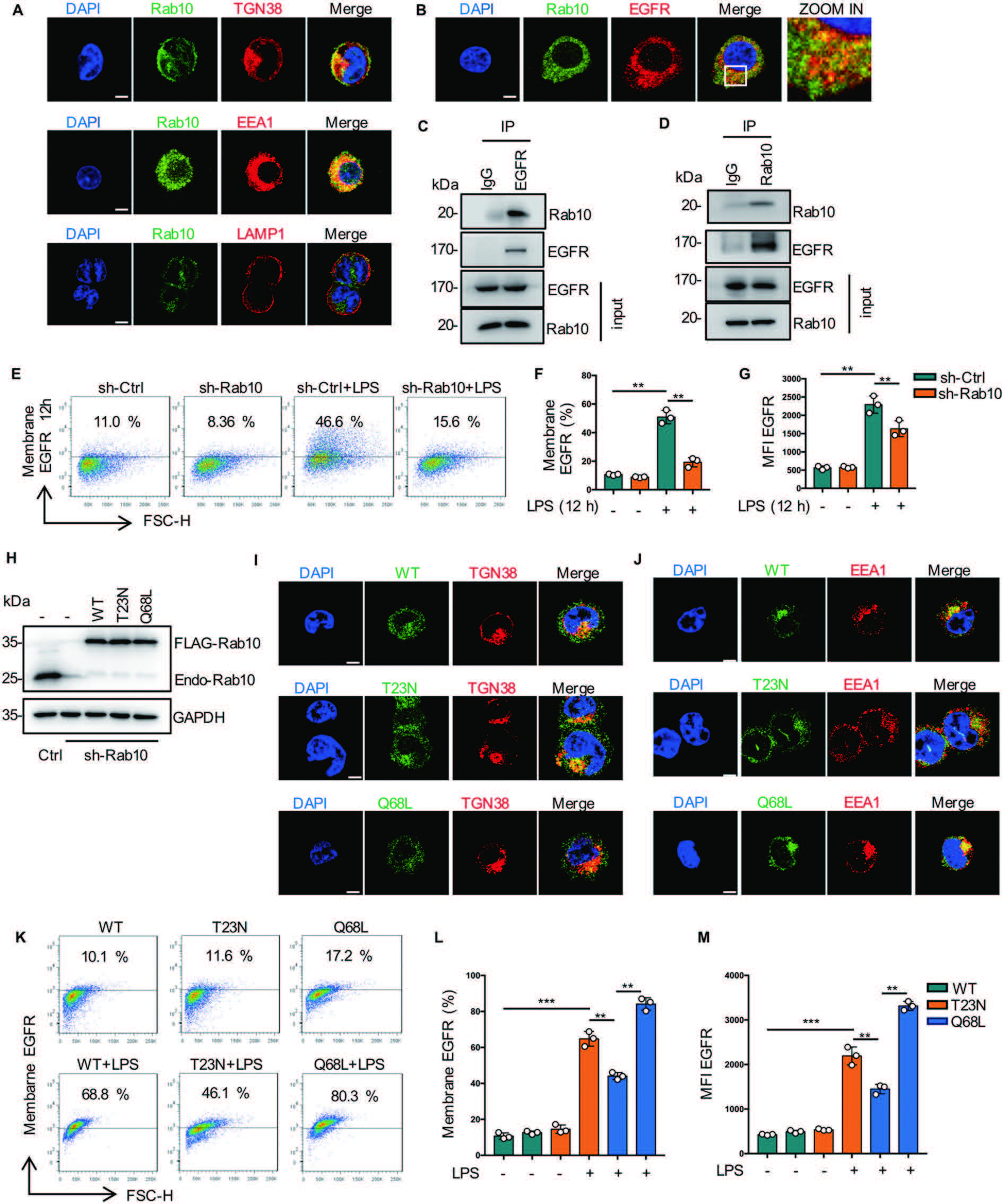
图6 Rab10促进EGFR从高尔基体运输到细胞表面
6. 抑制EGFR磷酸化可抑制巨噬细胞中糖酵解依赖性M1极化
为了评估细胞膜EGFR激活对脓毒症巨噬细胞M1/M2表型平衡的影响,作者使用LPS刺激BMDMs和RAW264.7两种巨噬细胞向M1表型转变。研究发现PD168393处理和Erlotinib处理(EGFR抑制剂)均显著下调了M1标志物iNOS的表达水平,即表明细胞表面的EGFR磷酸化促进内毒素血症或败血症相关的M1巨噬细胞的激活。为了进一步阐明EGFR对内毒素血症代谢的影响,作者开展了代谢组学分析,结果表明LPS组磷酸戊糖通路(PPP)和糖酵解中间产物增加、PD168393的处理降低HIF-1ɑ和乳酸脱氢酶A (LDHA)蛋白表达。综上所述,抑制EGFR磷酸化可以减少巨噬细胞对LPS的糖酵解反应(图7)。
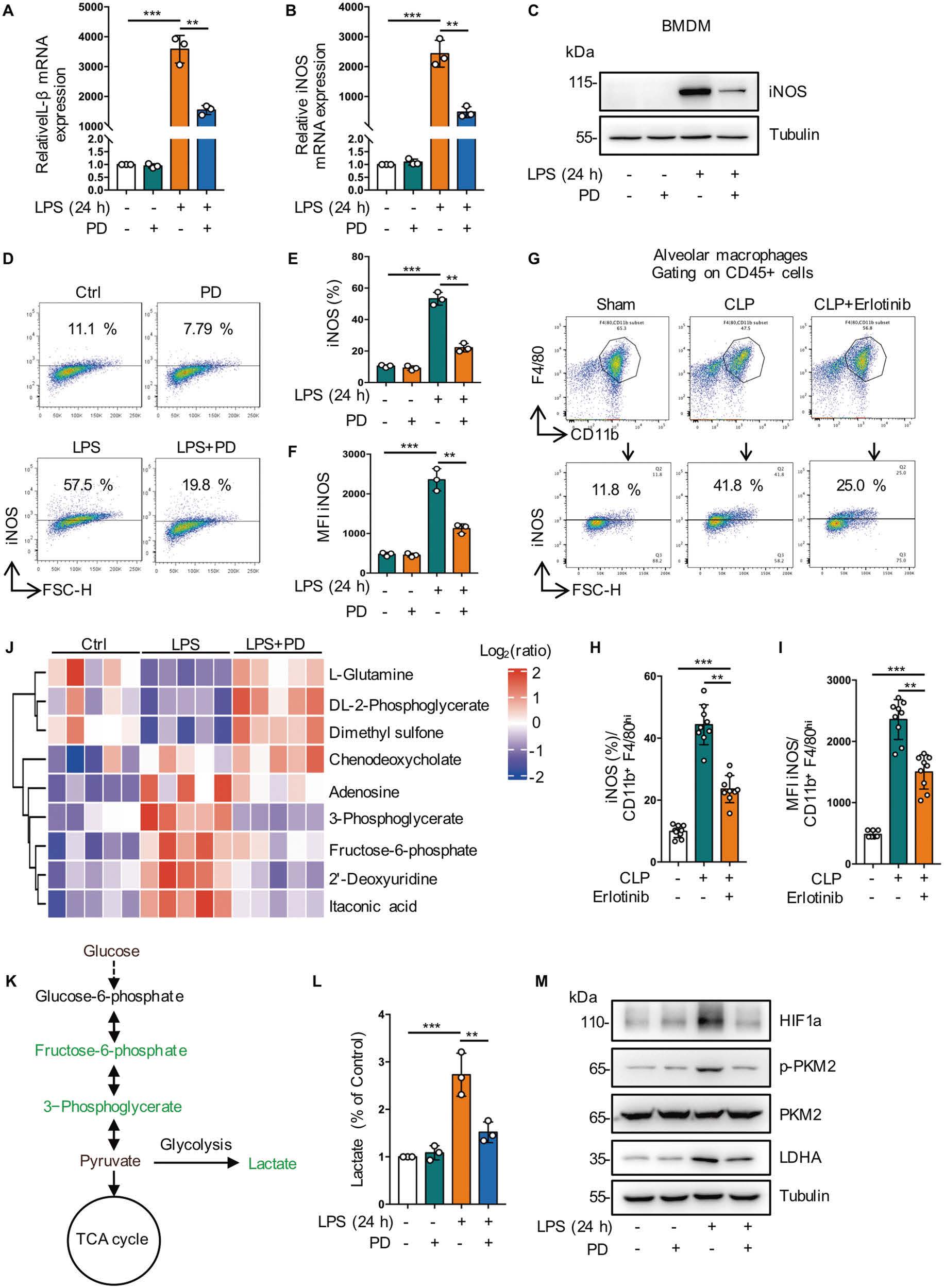
图7 抑制EGFR磷酸化可抑制巨噬细胞中糖酵解依赖性M1极化
7. 抑制EGFR磷酸化通过激活PPARγ调节谷氨酰胺代谢促进M2极化
作者接进一步研究了EGFR磷酸化在M2表型极化中的作用,结果表明Erlotinib处理后,M2标志物CD206在细胞和小鼠体内均显著增加,即意味着抑制EGFR磷酸化促进脓毒症期间M2巨噬细胞极化(图8A-8J)。PPARγ控制巨噬细胞谷氨酰胺代谢,在M2极化和代谢之间提供联系,而M2极化需要谷氨酰胺。代谢组学分析表明,PD168393处理后谷氨酰胺水平升高,且PD168393显著促进了PPARγ的激活,CD206的表达随着PPARγ的激活而增加(图8J-8K)。综上所述,抑制EGFR磷酸化通过激活PPARγ调节谷氨酰胺代谢从而促进M2极化。
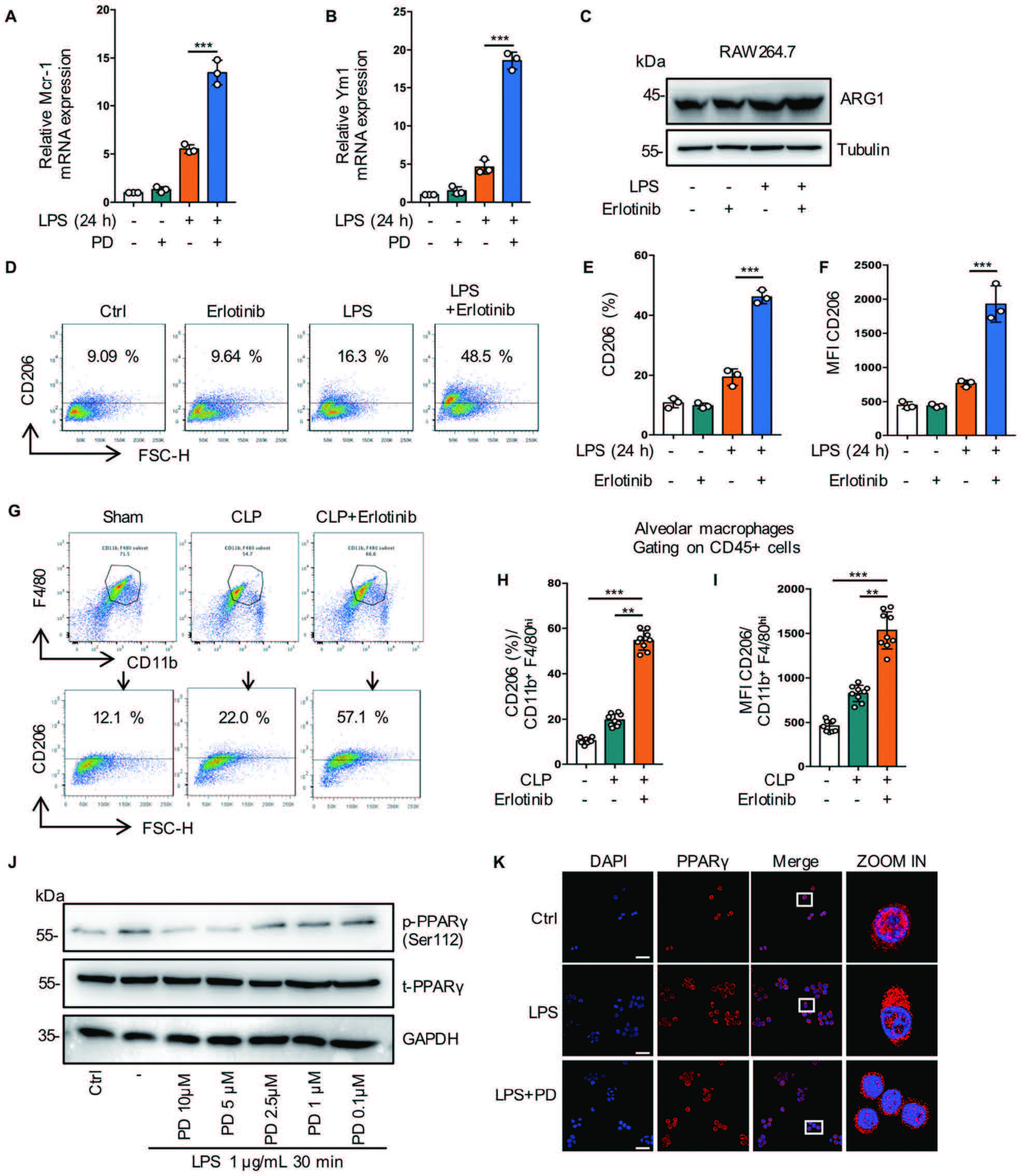
图8 抑制EGFR磷酸化通过激活PPARγ调节谷氨酰胺代谢促进M2极化
8. 抑制EGFR磷酸化可使M1表型转变为M2表型,减轻脓毒症引起的急性肺损伤
为了进一步验证EGFR抑制剂在体内对炎症和巨噬细胞极化的影响,应用LPS和CLP诱导的急性肺损伤(ALI)小鼠模型发现,在给予Erlotini的小鼠中,M2标志物CD206的表达增加,而M1标志物iNOS的表达减少。此外,Erlotini明显减少了中性粒细胞的浸润减弱了炎症细胞浸润、间质水肿和肺泡间隔增厚。综上表明,EGFR抑制剂可能通过调节体内巨噬细胞极化和减少炎症来改善脓毒性(图9)。
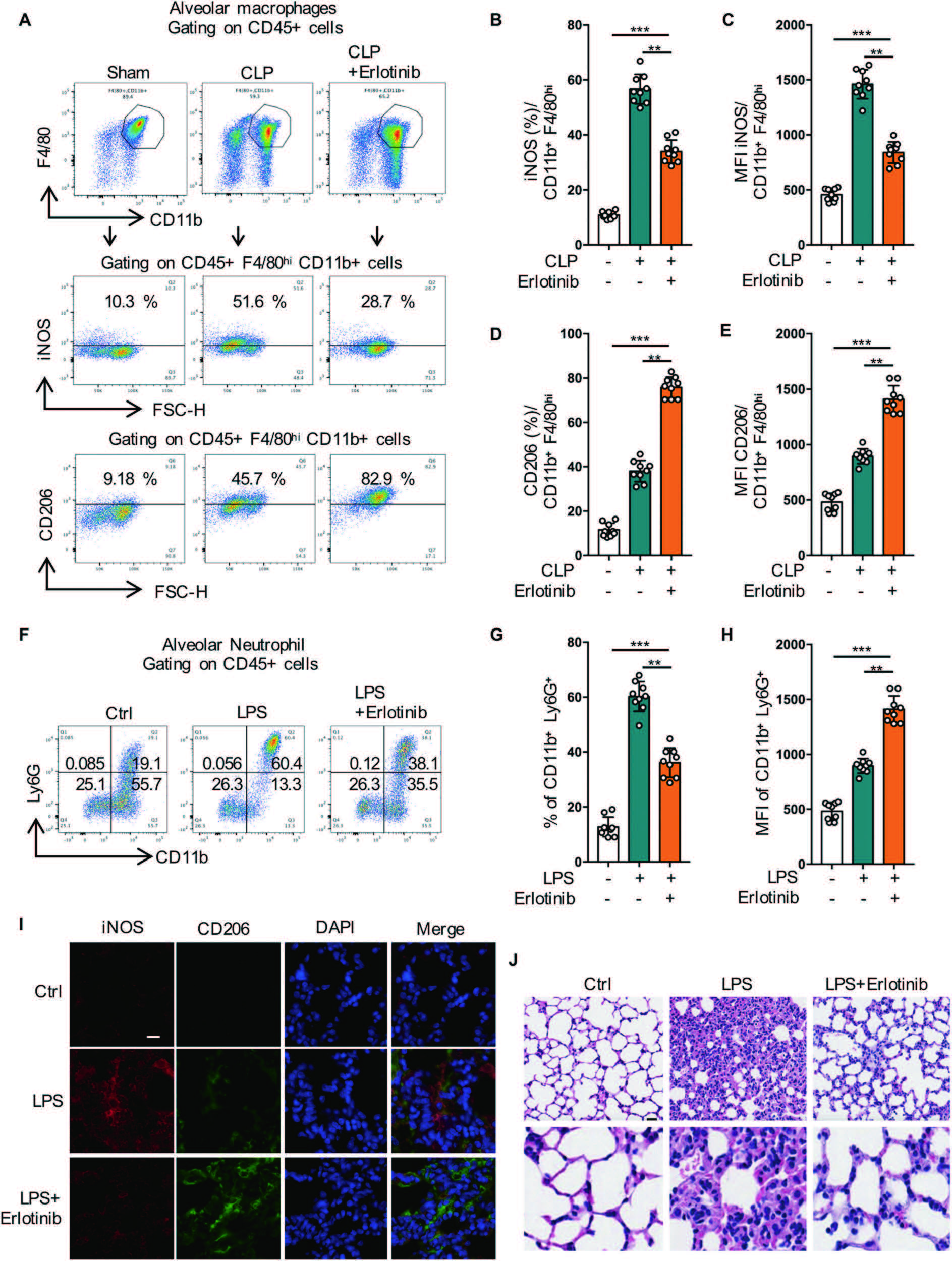
图9 抑制EGFR磷酸化可使M1表型转变为M2表型,减轻脓毒症引起的急性肺损伤
小编小结
该研究发现在LPS作用下,巨噬细胞表面EGFR的表达增强。然后通过磷酸化修饰组和代谢组学等方法揭示了EGFR的整个细胞转运过程,包括质膜易位、早期内化和晚期内吞,以及调控这些过程的特异性Rab蛋白的分子机制。此外,作者还发现细胞表面EGFR水平调节巨噬细胞M1/M2极化表型转化,并通过代谢重编程影响脓毒症诱导的多器官损伤。该研究为EGFR作为脓毒症治疗的潜在靶点提供了有力的证据。
